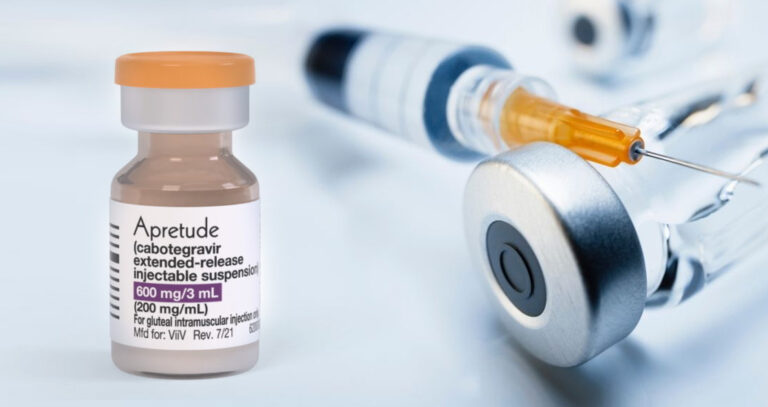
FDA phê duyệt phương pháp ngăn ngừa trước phơi nhiễm với HIV đầu tiên bằng đường tiêm
Vào ngày 20/12/2021, FDA đã chấp thuận thuốc Apretude đường tiêm trong sử dụng phòng ngừa trước phơi nhiễm HIV ở đối tượng nguy cơ cao để giảm nguy cơ lây nhiễm HIV qua đường tình dục.